⑧ 当 24 孔板内细胞密度达到 80%以上时,消化细胞移入 T-25 细胞培养瓶中扩大培养。
⑨冻存细胞,备用。
2.5 Western blot检验
在 6 孔板内分别接种相同数目的 Rin-m5F野生型细胞和步骤“2.4”项下获得的Rin-m5F/GLP1R-GFP单克隆细胞株,在完全培养液中培养至细胞密度长至90%左右。PBS 洗 2 遍,每孔加 200 μL2%SDS 裂解液,收取蛋白样品。置于 100℃水浴 10 min,加入 40μL的 6× 上样 Buffer稀释,置于 100℃水浴 10 min。Western blot实验方法见参考文献[14] 。
2.6 模型验证
实验分为空白对照(完全培养基)、溶剂对照(培养基加入 1%PBS、1%酒精、1%DMSO)、阳性对照(GLP1R 靶点药剂,百泌达)、阴性对照(非 GLP1R靶点药剂,格列本脲)。不同浓度药物处理相同时间:浓度设置为 0.25、0.5、2.5、5 μg·mL- 1 ,均处理 1 h。相同浓度药物处理不同时间:药物浓度为 0.25μg·mL- 1 ,分别处理 10、20、40、120 min。
操作流程:
① 将无菌圆形玻片在酒精灯火焰上来回灼烧数次,冷却后平铺在 24 孔板内,每孔一片;
②取“2.4”项下获得的单克隆细胞 Rin-m5F/GLP1R-GFP接种于圆形玻片上,轻轻摇晃培养板,使细胞均匀分布在板内,过夜至细胞密度长至 85%以上;
③ PBS 洗2 遍,加入含不同浓度药物的培养基 37℃孵育不同时间;
④ 吸弃培养液,PBS 洗 3 遍。加入 500 μL 4%多聚甲醛固定细胞 10 min,吸弃,PBS 洗 3 遍;
⑤ 取洁净载玻片,滴加 20 μL防荧光淬灭粘片剂,用镊子轻轻夹起圆形玻片,轻轻倒扣在防荧光淬灭粘片剂上,防止气泡产生;
⑥ 将玻片置于暗室通风干燥过夜,制好的玻片于激光共聚焦荧光显微镜下观察并拍照。
2.7 数据统计与分析
采用 SPSS 17.0 软件进行统计学分析。数据以均数 ± 标准差(x±s)表示,组间采用单因素方差分析,各组均数都采用 LSD(Least-significant differencetest)检测,若 P < 0.05 为差异有统计学意义。
3、结果
3.1 细胞形态观察
细胞 Rin-m5F复苏时在显微镜下观察,细胞基本呈单个、圆形均匀分布在新鲜完全培养基内,细胞密度为 50%左右,培养基中无明显杂质。过夜培养后,细胞贴壁率为 90%以上,细胞轮廓清晰、多呈不规则形状分布,多呈岛状聚集铺开生长。经胰酶消化,显微镜下观察显示细胞逐渐变圆,细胞间开始出现间隙。吹打成单个以 1∶3 传代至 3 代时,细胞形态正常、生长速率恢复到最佳,每 2 ~ 3 日即可传代(见图 1)。
图 1 Rin-m5F细胞显微镜观察图(200×)
Fig 1 Micro-observation of Rin-m5F cell lines(200×)
3.2 转染及其体系优化
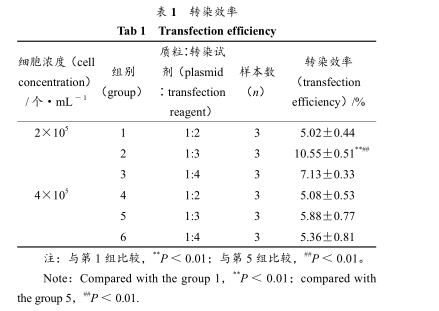
转染时在细胞接种量、质粒∶转染试剂 2 个方面进行优化,转染 24 h 后,倒置荧光显微镜下观察转染成功的细胞整个分布绿色荧光、荧光强度不一。拍照、统计转染效率分别见表 1。
表 1 转染效率Tab 1 Transfection efficiency
3.3 选择合适的 G418 筛选浓度